Уравнения химических реакций — основа химии как науки, и без навыка записи реакций не получить пятерку за контрольную или высокий балл на ЕГЭ. В статье разбираемся, как написать уравнение реакции, отрабатываем алгоритм записи и анализируем задания ОГЭ и ЕГЭ.
В этой статье:
Что такое уравнения химических реакцийТипы химических реакцийКоэффициенты в уравнениях химических реакцийАлгоритм составления уравнений химических реакцийЧто важно знать об уравнениях при подготовке к ОГЭ и ЕГЭ
Что такое уравнения химических реакций
Химия — это наука о превращении одних веществ в другие. Профессия химика не может существовать без проведения химических реакций. Однако как фиксировать процесс проведения эксперимента? Описывать всё словами, как вы привыкли это делать в других предметах?
Для описания превращений используют свою особую информативную запись — уравнения химических реакций. Так, опираясь на небольшой набор символов, специалист сможет понять, какие вещества вступили в химическую реакцию, а какие образовались.
Уравнения химических реакций принято записывать в следующем формате:
- В левой части располагаются реагенты, вступающие в химическую реакцию.
- В правой части находятся продукты химической реакции.
- Левую и правую части связывает знак → — он показывает направление химической реакции.
Попробуем расшифровать процесс, записанный в виде химической реакции:
4Fe + 3O2 + 6H2O → 4Fe(OH)3
Многие встречали ржавые металлические детали — на их поверхности образуется рыжий налет. Это химический процесс, а значит, его можно описать при помощи уравнения химической реакции.
В реакцию вступили железо, кислород и вода. В процессе химической реакции образовался гидроксид железа (III).
Очевидно, что текстовая форма записи сложнее: она громоздкая, при этом не несет информации о соотношении веществ в реакции. Чтобы избежать этих сложностей, химики пришли к единому заключению — описывать химические процессы при помощи химических символов. Разберемся, как составлять уравнения химических реакций.
Типы химических реакций
В зависимости от того, какая характеристика рассматривается, реакции классифицируют по разным признакам:
- по количеству реагентов и продуктов химической реакции;
- изменению степеней окисления;
- тепловому эффекту;
- направлению;
- агрегатному состоянию;
- наличию катализатора.
Рассмотрим первую классификацию — по количеству реагентов и продуктов химической реакции. Принято выделять:
- реакцию соединения;
- реакцию разложения;
- реакцию замещения;
- реакцию обмена.

Реакция соединения
Что первым приходит в голову, когда вы слышите слово «соединение»? Например, были две детальки, которые при соединении образовали новую. Именно это и описывает реакция соединения.
Вид: А + В → АВ
Особенность: в продуктах всегда находится одно вещество.
Пример реакции — процесс образования аммиака:
N2 + 3H2 ↔ 2NH3
Реакция разложения
Полной противоположностью соединения является разложение.
Вид: АВ → А + В
Особенность: в реагентах всегда находится одно вещество.
Например, разложение карбоната кальция происходит при действии на него высоких температур. Запишем реакцию:
CaCO3 → CaO + CO2
Реакция замещения
В процессе химической реакции атомы химического элемента простого вещества замещают атомы химического элемента в сложном.
Вид: А + ВС → АС + В
Особенность: простые и сложные вещества и в реагентах, и в продуктах реакции.
Заместить атомы йода из раствора йодида калия может молекулярный хлор:
2KI + Cl2 → 2KCl + I2
Реакция обмена
Реакция, в которой участвуют исключительно сложные вещества, называется реакцией обмена.
Вид: АВ + CD → АD + CB
Особенность: участвуют только сложные вещества.
Если окунуться в химизм подобных реакций, их существование возможно только при образовании газа, осадка или воды. Пример — нейтрализация соляной кислоты гидроксидом натрия:
NaOH + HCl → NaCl + H2O
Разобрать остальные типы химических реакций вы сможете на курсах подготовки к ОГЭ и ЕГЭ в MAXIMUM Education. Опытный преподаватель простым языком объяснит теорию, необходимую для успешной сдачи экзамена. А отработать ее вы сможете на актуальных заданиях, которые составляют наши методисты по прототипам ФИПИ. Всё это — онлайн в удобное для вас время! Переходите на сайт и выбирайте удобный формат занятий.
Коэффициенты в уравнениях химических реакций
Помимо химической символики, в уравнениях присутствуют цифры. Причем часть из них записывается внутри молекулы, а часть — снаружи.
Маленькие цифры принято называть индексами. При помощи индексов химики показывают, какое количество атомов содержится внутри одной молекулы. Если атом один, его индекс не указывают.
Крупные цифры перед формулой — это коэффициенты. При помощи коэффициентов можно показать, какое количество молекул вступает в химическую реакцию.
2FeCl2 + Cl2 → 2FeCl3
Например, в этой реакции двойки перед хлоридами железа (II) и железа (III) — это коэффициенты.
Тройка в хлориде железа (III) — это индекс. Аналогично и с другими веществами.
Если превращение описывается уравнением, при его составлении нужно приходить к равенству атомов в левой и правой частях уравнения.
Рассмотрим реакцию нейтрализации соляной кислоты гидроксидом натрия:
NaOH + HCl → NaCl + H2O
Посчитаем количество атомов в обеих частях уравнения. Сделать это можно в таблице:
| Na | Cl | H | O | |
| Реагенты | 1 | 1 | 2 | 1 |
| Продукты | 1 | 1 | 2 | 1 |
Количество атомов совпадает в обеих частях уравнения. Значит, коэффициенты расставлять не нужно — перед каждым веществом стоят единицы, их принято не писать.
Однако так случается далеко не всегда. Рассмотрим реакцию взаимодействия магния с соляной кислотой:
Mg + HCl → MgCl2 + H2
Аналогично посчитаем количество атомов в обеих частях уравнения:
| Mg | Cl | H | |
| Реагенты | 1 | 1 | 1 |
| Продукты | 1 | 2 | 2 |
Равенство не выполняется: хлора и водорода в продуктах в два раза больше. Исправим это, удвоив молекулу соляной кислоты. Тогда реакция будет уравнена и корректна:
Mg + 2HCl → MgCl2 + H2
Алгоритм составления уравнений химических реакций
Теперь вы знаете как составлять уравнения химических реакций. Зафиксируем, как решать химические реакции:
- Разделите химические вещества на продукты и реагенты. Реагенты запишите в левой части уравнения, продукты — в правой. Соедините две части при помощи символа «→».
- Посчитайте количество атомов в левой и правой частях уравнения.
- Если количество атомов не совпадает, перейдите к процессу расстановки коэффициентов.
Отработаем алгоритм на задании:
Запишите уравнение для описанного превращения. Расставьте коэффициенты.
К раствору хлорида магния добавили гидроксид натрия. В процессе реакции образовался белый осадок гидроксида магния, а также хлорид натрия.
Шаг 1. Запишем формулы реагентов и продуктов:
MgCl2 + NaOH → Mg(OH)2 + NaCl
Шаг 2. Перейдем к подсчету атомов в обеих частях уравнения:
| Mg | Cl | Na | O | H | |
| Реагенты | 1 | 2 | 1 | 1 | 1 |
| Продукты | 1 | 1 | 1 | 2 | 2 |
Шаг 3. Без коэффициентов не обойтись — приступим к уравниванию. Расходятся сразу несколько атомов — чтобы не запутаться, запомните простую последовательность:
- сначала уравнивайте атомы металлов и неметаллов, кроме водорода и кислорода;
- затем уравнивайте водород;
- в конце считайте атомы кислорода.
Уравняем хлор, поставив двойку у хлорида натрия:
MgCl2 + NaOH → Mg(OH)2 + 2NaCl
Тогда увеличивается и количество атомов натрия. Слева один натрий, а справа два. Поставим двойку у гидроксида натрия:
MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl
Считаем водород — по два атома в обеих частях уравнения. Отлично, завершаем работу подсчетом атомов кислорода. Их также по два атома — это говорит нам об успешном уравнивании превращения!
Что важно знать об уравнениях при подготовке к ОГЭ и ЕГЭ
Уравнивание реакций — навык, без которого тяжело представить решение большинства химических заданий. Особенно он важен при выполнении второй части ОГЭ и ЕГЭ.
Задания на запись уравнений реакций
В КИМ есть задания, которые буквально проверяют ваши навыки записи уравнений реакций. Например, номер 21 в ОГЭ посвящен расшифровке цепочки химических превращений. Вопрос оценивается в 3 балла:

Задания 31–32 в ЕГЭ проверяют умения выпускника записывать уравнения с участием неорганических и органических веществ. Суммарно за два вопроса можно получить 9 первичных баллов!

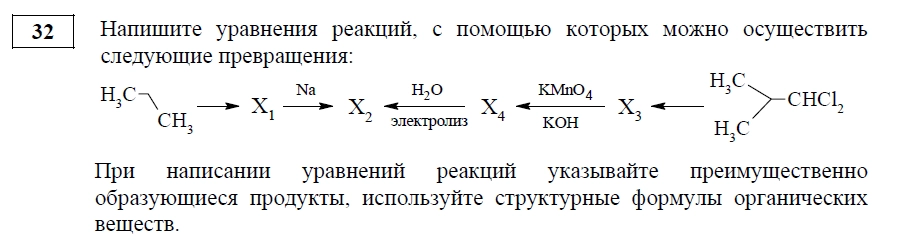
Основная сложность этих заданий в том, что для написания реакции нужно знать химические свойства веществ. Представьте, что самый сложный этап пройден — вы поняли, какое превращение необходимо написать, и определили продукты реакции. Однако за реакцию выставлено 0 баллов. В чем дело?
Обратимся к рекомендациям ФИПИ по проверке второй части ЕГЭ:
Уравнение реакции считается записанным верно, если правильно записаны все формулы веществ — участников реакции, присутствуют все коэффициенты, продукты реакции соответствуют условиям проведения реакции.
Выходит, потеря коэффициентов в уравнении реакции приравнивается к грубой ошибке, за которую могут поставить 0 баллов.
В большинстве случаев подобные ошибки появляются из-за невнимательности. Вот на что стоит обратить внимание при заполнении бланка ответов:
- Коэффициенты. Они должны быть записаны соответственно у каждого вещества.
- Индекс. Неверно записанный индекс — это ошибка в записи формулы химического вещества, а значит, и химического уравнения.
- Кислород. Пересчитайте кислород в переписанном уравнении: если он совпадает, то и реакция уравнена верно.
Расчетные задачи
Еще один тип заданий, решение которых невозможно представить без записи уравнений, — расчетные задачи. Коэффициенты в уравнении — это единицы отношения, опираясь на которые можно установить соотношение веществ в реакции.
Как в задании 22 ОГЭ, так и в задачах 33–34 ЕГЭ, запись уравнений химических реакций оценивается одним баллом.

Без расстановки коэффициентов невозможны корректные расчеты, что автоматически приводит к неудовлетворительным результатам решения задачи.
Всё это говорит о том, что для получения хорошего результата вам необходимо овладеть целой совокупностью знаний, которые объединяются в процессе написания уравнений химических реакций.
Отработать этот навык на максимум вы сможете на курсах подготовки к ОГЭ и ЕГЭ в MAXIMUM Education. На занятиях вас ждут видеолекции с выжимкой теории, рабочие тетради и конспекты, обратная связь по домашкам и пробные экзамены. С таким подходом пятерка на ОГЭ или сотка на ЕГЭ будут вашими 💯












